Comité Ético Científico
Con fecha 30 de Agosto de 2023, la SEREMI Metropolitana de Salud, ha dictado la resolución N° 2313311131 en donde aprueba la solicitud de ACREDITACIÓN DE COMITÉ ÉTICO CIENTÍFICO, en el Hospital Padre Alberto Hurtado, lo que nos habilita para la revisión de ensayos clínicos farmacológicos y/o con dispositivos médicos.
La misión de los comités de Ética Científica (CEC) es velar por la seguridad, integridad y respeto de los derechos de los sujetos que participan en proyectos de investigación a través del cumplimiento de las normas éticas universales que regulan la investigación científica en seres humanos.

Contacto a través de los correos: cec@hurtadohosp.cl ; eticacientifico.hph@gmail.com
Quedan a su disposición:
- Resoluciones
- N° 2672 SSMSO Establece CEC HPH
- N° 15/2022 HPH Designa Integrantes
- N° 1180/2022 HPH Aprueba RI
- N° 2988/2022 HPH Incorpora miembro de la Comunidad
- N° 10/2023 HPH Modifica RI
- N° 2672 SSMSO Establece CEC HPH
- Reglamento Interno Resolución N° 178/2023 HPH
- Resolución de AcreditaciónN° 2313311131
- Norma para la Realización de Investigaciones Biomédicas en Seres Humanos (Actualizada en Diciembre de 2019)
Primera Memoria del CEC período 2023-2024
Documentación que se requiere adjuntar para la evaluación de un proyecto de investigación:
- Carta dirigida al presidente del Comité solicitando la revisión de su proyecto, debe incluir un listado de los documentos enviados con numeración, nombre, versión con la respectiva fecha y explicitar si el proyecto ha sido enviado a revisión por otro CEC identificándolo; en caso de haber sido aprobado por otro Comité adjuntar el Acta correspondiente. Si el proyecto o producto a utilizar ha sido aprobado por el ISP, adjuntar el certificado respectivo.
- Copia del memorándum enviado al Jefe del Centro de Responsabilidad (CR) o Unidad de Apoyo Terapéutico (UAT) en donde se planifica efectuar el estudio. En caso de llevarse a cabo en más de un CR o UAT debe adjuntar la de ambas jefaturas.
- Copia del memorándum enviado por el o los Jefe(s) del CR o UAT al Director del establecimiento solicitando la evaluación por el CEC HPH.
- Proyecto en extenso, Manual del investigador en caso de que corresponda en su última versión, con número de versión y fecha de la versión (en Word) en español. Tratándose de proyectos muy extensos, incluir resumen ejecutivo.
- Seguro de responsabilidad civil en caso de ensayos clínicos, si corresponde.
- Currículum vitae actualizado de todos los investigadores participantes con firma y fecha, adjuntando copia de los certificados que acrediten su idoneidad como investigadores, entre ellos, los Certificados de Buenas Prácticas Clínicas (BPC).
- Declaración de los aspectos económicos del proyecto, incluir la entrega de regalos, gift card u otros similares como incentivo o retribución para los participantes.
- Descripción de las funciones que realizarán los co-investigadores deben estar definidas y especificadas en el proyecto.
- Anexo 1_Presentación proyecto de investigación al HPH avalado con la firma de la jefatura del CR o UAT.
- Anexo 2_Declaración de conflictos de interés de cada uno de los investigadores o co-investigadores.
- Anexo 3_Compromiso confidencialidad de los investigadores avalado con la firma de la jefatura del CR o UAT.
- Anexo 4_Carta de compromiso del investigador.
- Formulario(s) de Consentimiento Informado con versión y fecha de versión, en caso de que aplique. (Nota: Si Ud. cree que no requiere este documento debe solicitar la dispensa al CEC fundamentando las razones, recuerde que es el Comité quien definirá si ello es posible).
- Formulario(s) de Asentimiento Informado con versión y fecha, en caso de que aplique. Recuerde que en caso de aplicar Asentimiento Informado también requiere del Consentimiento del adulto responsable.
- Material de apoyo para:
- Reclutamiento para los participantes (cartas, afiches, flyer escritos o digitales, incluye aquellos a utilizar eventualmente en redes sociales).
- Encuestas, cuestionarios, pautas o guiones de entrevistas individuales o grupales, instrumentos de evaluación, tarjetas o cuadernos de registros, recordatorios, citaciones.
- Contenido informativo o programas educativos ya sea como parte del proyecto o a modo de compensación, retribución o incentivo por participar.
INTEGRANTES


REGLAMENTO
Resolución Exenta N° 178-2023
RESOLUCIÓN
Aprobación Acreditación
ANEXOS
Flujo y documentos para presentación de proyectos
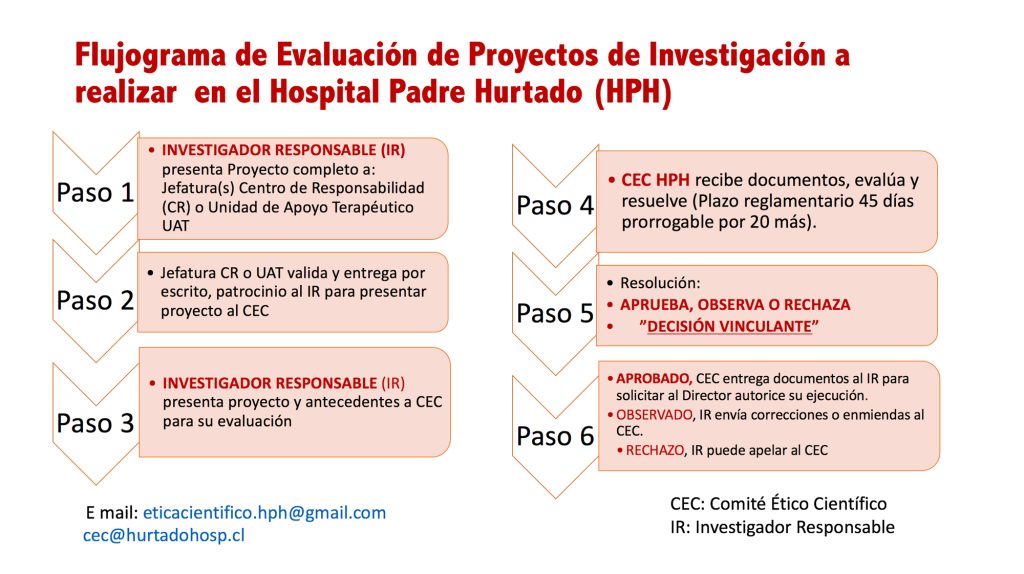
DOCUMENTOS QUE DEBE PRESENTAR EL INVESTIGADOR:
















